Ritorno al futuro: dal 2023 al 1989

Ritorno al futuro: dal 2023 al 1989
A cura di
Serena Guasti
Centro di Ecocardiografia Clinica, S.C. Cardiologia 4 Diagnostica-Riabilitativa
Massimilliano Carrozzini
S.C. Cardiochirurgia
Un uomo di 65 aa, con dislipidemia lieve e familiarità per cardiopatia ischemica, senza precedenti cardiologici di rilievo, esegue un ecocardiogramma color Doppler di controllo presso il nostro Centro. All’esame viene riscontrato un localizzato aumento dello spessore (18 mm) del segmento basale e di parte del medio del setto interventricolare con disomogeneità della texture miocardica, che presenta alcuni spot iperecogeni, in assenza di accelerazione o ostruzione all’efflusso; la funzione sistolica globale del ventricolo sinistro appare conservata e non vengono evidenziati ulteriori reperti di rilievo.
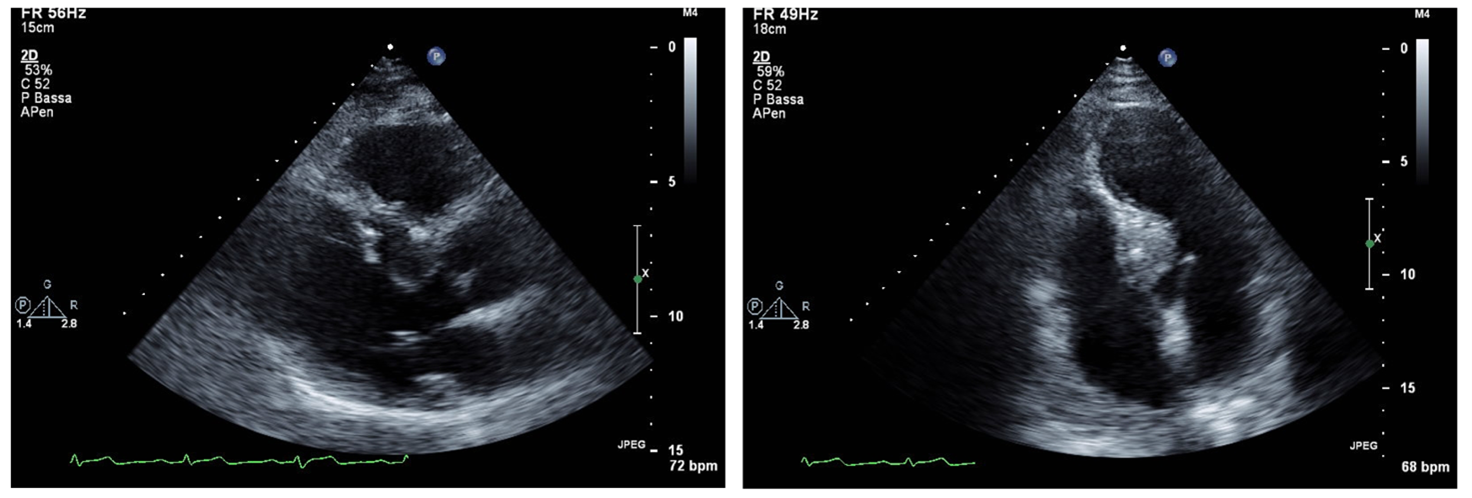
Il paziente viene sottoposto a distanza di pochi giorni ad ecografia con contrasto (Sonovue 1 cc) che mostra una perfusione disomogenea della formazione settale.

Il paziente riferisce benessere clinico, nessuna sintomatologia cardiaca e nulla di rilevante agli esami ematici, inclusi troponina e indici infiammatori.
L’elettrocardiogramma a 12 derivazioni documenta un ritmo sinusale con BAV di I grado e blocco di branca destra incompleto in assenza di alterazioni significative della ripolarizzazione ventricolare.

Per una miglior caratterizzazione, lo studio del reperto ecografico viene approfondito con risonanza magnetica cardiaca che evidenzia una massa ovalare a margini netti del setto interventricolare basale, senza segni di infiltrazione del miocardio (dimensioni 30x34x38 mm APxLLxCC), ipointensa nelle sequenze T1-pesate e STIR. La massa non presenza significativo enhancement precoce e si impregna progressivamente ed in modo disomogeneo alle immagini tardive post-contrasto con evidenza di rim iperintenso periferico e probabili calcificazioni intralesionali. Queste caratteristiche tissutali sono suggestive per fibroma cardiaco.
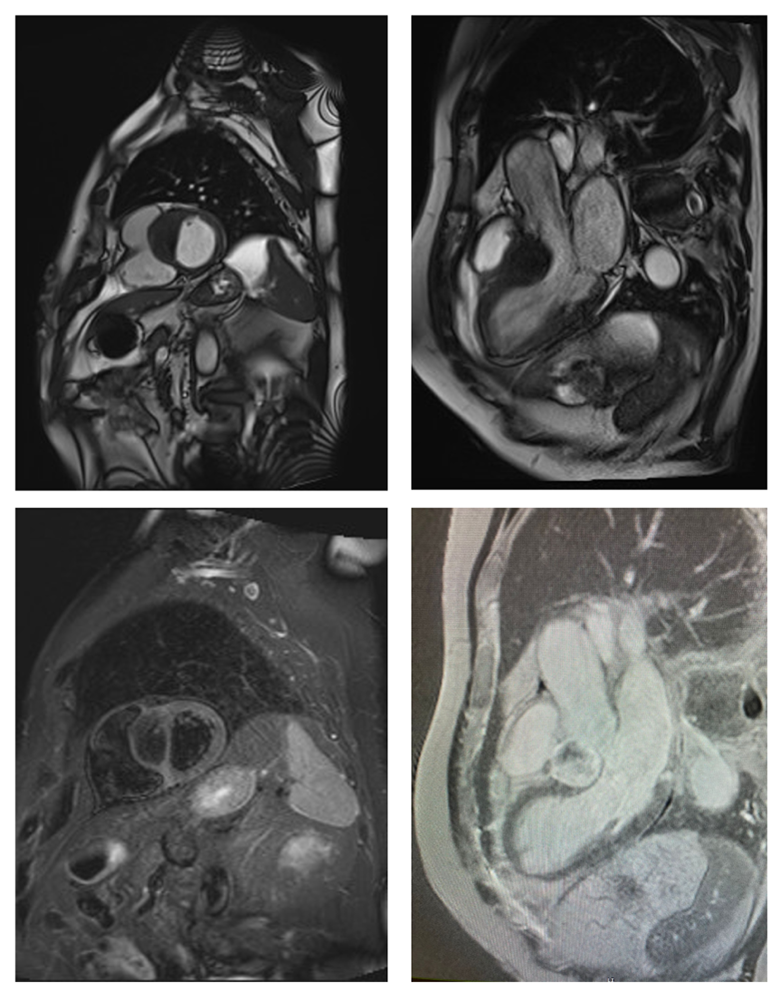
Courtesy of Patrizia Pedrotti and Daniela Di Marco
A completamento diagnostico per conferma delle microcalcificazioni e per studiare la relazione con l’albero coronarico viene eseguita una TC cardiaca con mezzo di contrasto. Tale esame rileva che la lesione non è significativamente vascolarizzata in fase arteriosa mentre presenta enhancement sostanzialmente omogeneo prevalentemente tardivo; questi reperti depongono ancora per la natura fibrotica della massa. Sono poi confermate la presenza di calcificazioni e l’assenza di alterazioni a carico dell’albero coronarico.

Si esegue, infine, un Holter ECG delle 24 ore, che registra un ritmo sinusale tendenzialmente bradicardico, in assenza di pause significative o attività extrasistolica ventricolare.
Approfondendo la storia clinica, il paziente porta in visione il referto di un’ecocardiografia del 1989, alle cui immagini appare già riscontrabile la massa, di dimensioni sostanzialmente sovrapponibili alle attuali.

Il paziente è stato quindi avviato ad una valutazione cardiochirurgica che, in considerazione del riscontro occasionale in assenza di sintomatologia cardiologica, di aritmie e di ostruzione agli efflussi ventricolari, nonché della non evolutività della lesione rispetto al remoto controllo ecocardiografico, non pone indicazione attuale ad intervento cardiochirurgico ma a follow up clinico-strumentale a 6 mesi.
Discussione
I tumori cardiaci primitivi sono condizioni rare, con un'incidenza riportata dello 0,002%–0,3% nelle serie autoptiche [1]. I fibromi cardiaci sono lesioni amartomatose benigne, derivanti da fibroblasti o miofibroblasti cardiaci. Costituiscono il 2-5% dei tumori cardiaci primari e vengono solitamente rilevati in età pediatrica [2]. I fibromi cardiaci spesso coinvolgono la parete libera o il setto del ventricolo sinistro e meno frequentemente il ventricolo destro e gli atri. La presentazione clinica è estremamente eterogenea e varia a seconda delle dimensioni e della localizzazione del tumore (insufficienza cardiaca, dispnea, dolore toracico, sincope e morte improvvisa). Nel 50% dei casi, i fibromi cardiaci possono essere asintomatici e comparire come reperti occasionali durante procedure di diagnostica per immagini per altre indicazioni [2].
L’ecografia è generalmente la modalità diagnostica iniziale per valutare il fibroma cardiaco. Dà informazioni circa la localizzazione, le dimensioni e l’eventuale ostruzione o interferenza con gli apparati valvolari. Tipicamente appare come una lesione solida, con disomogenea texture miocardica e spot calcifici al suo interno. Inoltre, all’ecografia con contrasto risulta ipoperfusa, riflettendo una massa con scarsa vascolarizzazione [3].
L’impiego di metodiche di imaging di secondo livello, risonanza magnetica cardiaca e TC cardiosincronizzata, permettono di definire in modo non invasivo la natura della massa cardiaca. In particolare, la risonanza magnetica viene considerata il “gold standard” non invasivo, consentendo di caratterizzare la massa dal punto di vista tissutale e vascolare e di valutare l’infiltrazione delle strutture circostanti. Il fibroma è l'unico tumore con una combinazione di intensità del segnale isointensa nelle sequenze T1-pesate e ipointensa nelle sequenze T2-pesate [7]. Tuttavia, la diagnosi finale avviene con l’esame istopatologico. Istologicamente, i fibromi sono costituiti da fibroblasti e tessuto connettivo e sono caratterizzati dal grado di differenziazione cellulare. Con l’aumentare dell’età del paziente, il grado di cellularità e la densità di vasi sanguigni spesso diminuisce mentre la quantità di collagene aumenta, portando generalmente ad un inferiore tasso di crescita della massa [2].
Non esistono linee guida specifiche riguardo la gestione chirurgica dei fibromi e le casistiche disponibili in letteratura sono basate prevalentemente su serie di casi pediatrici e report di singoli casi adulti. Indicazioni classiche alla chirurgia sono la presenza di sintomi correlati alla massa, la significativa ostruzione agli efflussi ventricolari o la presenza di aritmie [4-6]. Quando possibile, la resezione completa o parziale della massa è la strategia chirurgica di scelta, con un’alta probabilità di successo nel risolvere la sintomatologia anche a distanza. Una recidiva di crescita della massa è possibile ma estremamente rara [5,6]. Alternativa chirurgica in casi di masse di grandi dimensioni non resecabili è il trapianto cardiaco ortotopico [1].
Torimitsu et al. hanno eseguito una review della letteratura inglese e giapponese, riportando i dati di 178 casi di fibroma cardiaco, con un’età media alla diagnosi di 2.8 anni, range 0-83 anni. Di questi, 119 casi erano stati sottoposti ad intervento chirurgico, con una mortalità complessiva del 18% (22 pazienti). Dall’analisi statistica, gli autori hanno concluso che una minore età alla diagnosi ed il coinvolgimento del setto interventricolare sono fattori di rischio per la mortalità. In particolare, il peggior outcome associato al coinvolgimento del setto sarebbe, secondo gli autori, dovuto al secondario danno a carico del sistema di conduzione del cuore [8].
Il caso presentato rappresenta un interessante esempio di riscontro occasionale di fibroma cardiaco in età adulta. La corretta rilevazione all’ecocardiografia transtoracica di un’alterata texture con spot iperecogeni nel contesto di un setto interventricolare “ipertrofico”, hanno consentito di porre il sospetto di massa intracardiaca, dando inizio al percorso diagnostico in un paziente completamente asintomatico. I successivi esami strumentali di secondo livello hanno permesso di definire la diagnosi e le caratteristiche della neoformazione. Fondamentali per il processo decisionale, sono poi stati l’Holter ECG, che ha escluso la presenza di aritmie, ed il riscontro di una massa di dimensioni similari ad un remoto controllo ecocardiografico precedente. La stabilità delle dimensioni della massa nel tempo non sorprende, dato che, come già esposto sopra, i fibromi cardiaci tendono a presentare la loro massima crescita entro i primi anni di vita. Allo stesso tempo, tale evidenza, unitamente all’assenza di ostruzione agli efflussi ventricolari e di aritmie, hanno facilitato la decisione terapeutica, orientando verso l’esclusione di un’attuale indicazione chirurgica. In casi simili, resta comunque necessario mantenere un adeguato follow-up periodico (generalmente ogni 6 mesi), per confermare la stabilità delle dimensioni della massa e l’assenza di aritmie cardiache o sintomatologia. Il coinvolgimento del setto interventricolare rappresenta un importante fattore prognostico nel nostro caso, imponendo un attento controllo elettrocardiografico per identificare tempestivamente un’eventuale progressione dell’iniziale ritardo di conduzione evidenziato. Qualora questo si verificasse, in assenza di un accrescimento dimensionale della massa o di ostruzione ventricolare o evidenza di substrati per aritmie maligne (i.e. extrasistolia ventricolare), la scelta terapeutica più ragionevole sarebbe comunque, in primis, l’impianto di un pacemaker.
In conclusione, i fibromi cardiaci in età adulta sono un’entità rara e possono costituire riscontro occasionale a controlli ecocardiografici di routine. Focali aree di ispessimento della parete libera del ventricolo sinistro o del setto interventricolare pongono generalmente il sospetto diagnostico, che richiede poi esami di secondo livello (RMN e TC) per la conferma e la caratterizzazione. Di fondamentale importanza sono la raccolta di un’accurata anamnesi e lo studio elettrocardiografico. La strategia terapeutica va valutata in base alle peculiari caratteristiche del singolo caso (localizzazione e dimensioni della massa, ostruzione agli efflussi ventricolari, coinvolgimento del setto interventricolare, età del paziente, presenza di sintomatologia ed aritmie) con un approccio multidisciplinare.
Bibliografia
[1] Rahouma M, Arisha MJ, Elmously A, El-Sayed Ahmed MM, Spadaccio C, Mehta K, et al. Cardiac tumors prevalence and mortality: A systematic review and meta-analysis. International Journal of Surgery 2020;76:178–89. https://doi.org/10.1016/j.ijsu.2020.02.039 .
[2] Burke A, Tavora F. The 2015 WHO Classification of Tumors of the Heart and Pericardium. Journal of Thoracic Oncology 2016;11:441–52. https://doi.org/10.1016/j.jtho.2015.11.009.
[3] Y Lin, M Xie, M Qian, L Gao, M M Ji, Y Li, Cardiac fibroma: characteristics on echocardiography and cardiac magnetic resonance imaging, QJM: An International Journal of Medicine, Volume 115, Issue 6, June 2022, Pages 412–414, https://doi.org/10.1093/qjmed/hcac062
[4] Stiller B. Primary cardiac tumours: when is surgery necessary? European Journal of Cardio-Thoracic Surgery 2001;20:1002–6. https://doi.org/10.1016/S1010-7940(01)00951-4.
[5] Nathan M, Fabozzo A, Geva T, Walsh E, del Nido PJ. Successful surgical management of ventricular fibromas in children. The Journal of Thoracic and Cardiovascular Surgery 2014;148:2602–8. https://doi.org/10.1016/j.jtcvs.2013.11.052.
[6] Cho JM, Danielson GK, Puga FJ, Dearani JA, McGregor CGA, Tazelaar HD, et al. Surgical resection of ventricular cardiac fibromas: early and late results. The Annals of Thoracic Surgery 2003;76:1929–34. https://doi.org/10.1016/S0003-4975(03)01196-2.
[7] O’Donnell DH, Abbara S, Chaithiraphan V, Yared K, Killeen RP, Cury RC, et al. Cardiac tumors: optimal cardiac MR sequences and spectrum of imaging appearances. American Journal of Roentgenology 2009;193:377–87. doi:10.2214/AJR.08.1895.
[8] Torimitsu S, Nemoto T, Wakayama M, Okubo Y, Yokose T, Kitahara K et al. Literature survey on epidemiology and pathology of cardiac fibroma. European Journal of Medical Research 2012;27;17(1):5. doi: 10.1186/2047-783X-17-5.







